Une approche plus clinique et cohérente que les guides numériques
Présentation d’une technique de chirurgie implantaire guidée permettant de certifier les axes planifiés sur modèle par forage et transférés sur l’image par un guide unique radiologico-chirurgical.
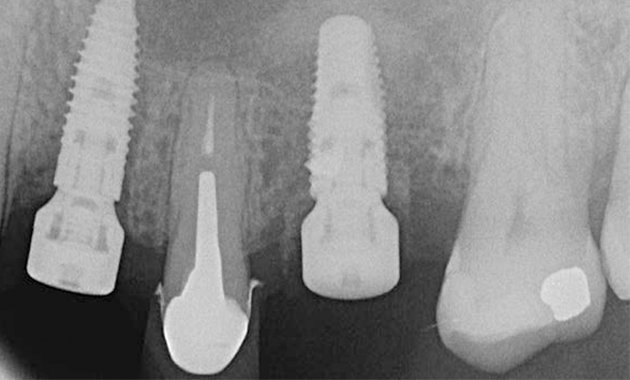
En implantologie, le geste opératoire à main levée encadrée impose un décollement de pleine épaisseur qui permette de décider de l’axe de forage. Le plan de traitement sera induit par ce geste peu précis et qui impose de prendre des repères et donc d’objectiver le contour osseux sur une hauteur suffisante. De plus, cette approche opératoire nécessite une zone de sécurité osseuse pour contrer l’effet de la parallaxe. Les décollements et les incisions nécessaires (sulculaires ou de décharge) imposent à la cicatrisation un challenge difficile, que ce soit au niveau osseux ou gingival [1, 2, 3] avec des résultats parfois hasardeux. De surcroît, plus un lambeau est étendu, plus sa stabilisation par la suture est difficile. Planifier l’axe de forage et le transférer en chirurgie par un guide précis...
Ce contenu est réservé aux utilisateurs inscrits sur le site dentaire365.fr
Déjà abonné ? Connectez-vous