L’implant en zircone : plus proche de la racine naturelle ?
Les implants en zircone peuvent apparaître comme une véritable alternative au titane chez nos patients et surtout ceux présentant un terrain allergique, des maladies auto-immunes, des facteurs de risques parodontaux et des intolérances aux métaux.
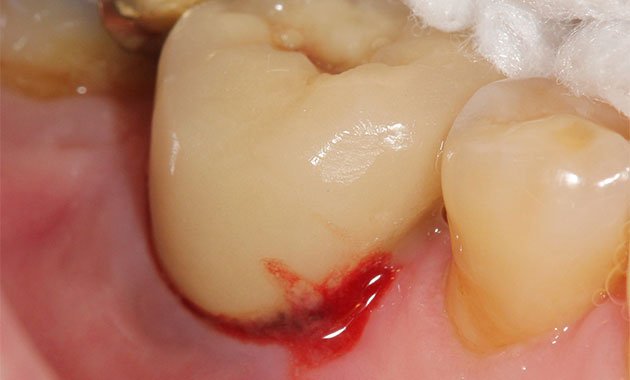
L’implantologie en titane est habituellement utilisée pour réhabiliter la fonction et l’esthétique suite à la perte des dents [1]. De nombreuses études ont démontré leur excellente biocompatibilité [2] et des taux de succès élevés [3]. Cependant la prévalence des péri-implantites (PI) autour des implants en titane [4], devrait être une préoccupation clinique quotidienne, vu l’importance de leur incidence (Fig.1a, b, c).
Fig.1a : Péri-implantite autour d'un implant en 46 et sa...
Ce contenu est réservé aux utilisateurs inscrits sur le site dentaire365.fr
Déjà abonné ? Connectez-vous